例1.下列说法中正确的是()
A、凡均一、稳定的液体一定是溶液
B、溶液的质量一定都等于溶质和溶剂的质量之和
C、泥浆水中,泥是溶质,水是溶剂
D、水能溶解很多物质,所以任何溶液里水都是溶剂
错解及错因不能准确把握溶液的三要素:混合物、均一性、稳定性。
解析溶液甚至不一定是液体,只要是均一、稳定的混合物就是溶液。但是均一、稳定的液体不一定是溶液。比如水,是纯净物,不属于溶液。
泥浆水根本不是溶液,是悬浊液,更谈不上溶质和溶剂;
水能溶解很多物质,但水不是唯一的溶剂,如碘酒中,酒精是溶剂。
正确答案是B。
点评严格按照定义来理解溶液,不能被常见的溶液挡住视线,若形成思维定势不利于化学的学习。
例2.判断下列溶液是否是饱和溶液,是否是浓溶液,用“√”和“×”填写。
(温度20℃,溶剂质量为100 g)。填表以后,说说你对溶液的“浓”“稀”、与溶液是否饱和之间的关系的看法?
|
物质 名称 |
溶解最 大质量 |
已溶解的质量 | 饱和溶液 | 不饱和溶液 | 浓溶液 | 稀溶液 |
| 氧化钙 | 0.18 g | 0.17 g | ||||
| 0.18 g | ||||||
| 硝酸钠 | 86 g | 84 g | ||||
| 86 g |
错解及错因溶液的浓或稀,是依据一定量溶剂里溶解溶质的多少来衡量;而饱和状态以一定温度时、一定量溶剂里是否还能继续溶解溶质来判断。二者没有必然的联系,不可混为一谈。
解析
|
物质 名称 |
溶解最大质量 | 已溶解的质量 | 饱和溶液 | 不饱和溶液 | 浓溶液 | 稀溶液 |
| 氧化钙 | 0.18 g | 0.17 g | √ | √ | ||
| 0.18 g | √ | √ | ||||
| 硝酸钠 | 86 g | 84 g | √ | √ | ||
| 86 g | √ | √ |
点评对于不同溶质来说,浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液;反过来,饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液。当然,对于同一种溶质的溶液来说,在一定温度时,饱和溶液比不饱和溶液要浓。
例3.下面是配制50 g质量分数为5%的氯化钠溶液的操作过程示意图,试回答:

(1)B操作中应称量氯化钠的质量是g,放好砝码和游码后,向托盘上加氯化钠时,若指针偏向分度盘的左边,应进行的操作是 。
(2)D操作应选用 毫升的量筒(从10mL、100mL中选择);量水时,量筒必须放平,视线要跟量筒凹液面的处保持水平。
(3)E操作的作用是。
错解及错因本题将枯燥的溶液计算与鲜活的学生实际操作结合起来,往往能暴露同学们在化学实验常识和实验技能上的不足。
解析⑴2.5,取出部分氯化钠,直至天平平衡 ⑵100mL,最低处 ⑶加速溶解
点评不管是化学实验还是科学研究,配制溶液都是很基本的技能,若平时不注意训练,就失去了理论联系实际的绝佳机会。
例4.如下图所示:欲使一杯10%的NaNO3溶液的溶质质量分数改变,请在横线上填出具体方法。
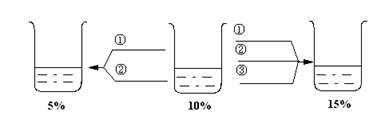
错解及错因只关注溶液=溶质+溶剂的质量关系,忽略了溶质、溶剂任何一项的质量改变都将使溶液质量也同时改变的事实。
解析10%~5%①加水的质量等于原溶液的质量,②加入溶质质量分数小于5%的溶液。如加入质量分数为2.5%的溶液质量为原溶液的2倍……
10%~15%:①加入溶质为原溶液质量的,②蒸发溶剂的质量为原溶液质量的 ,③加入等质量的20%的溶液……
点评化学计算与单纯的数学运算既有联系也有区别,要善于从不同角度去分析,注意化学实验过程中的特殊性是关键。
